Tasquinimod
Tasquinimod är en oralt aktiv småmolekylär immunmodulator med ett nytt verkningssätt som blockerar tumörstödjande signaler i mikromiljön i benmärgen. Tasquinimod utvecklas för behandling av hematologiska cancerformer, med fokus på myelofibros.
Detta är tasquinimod
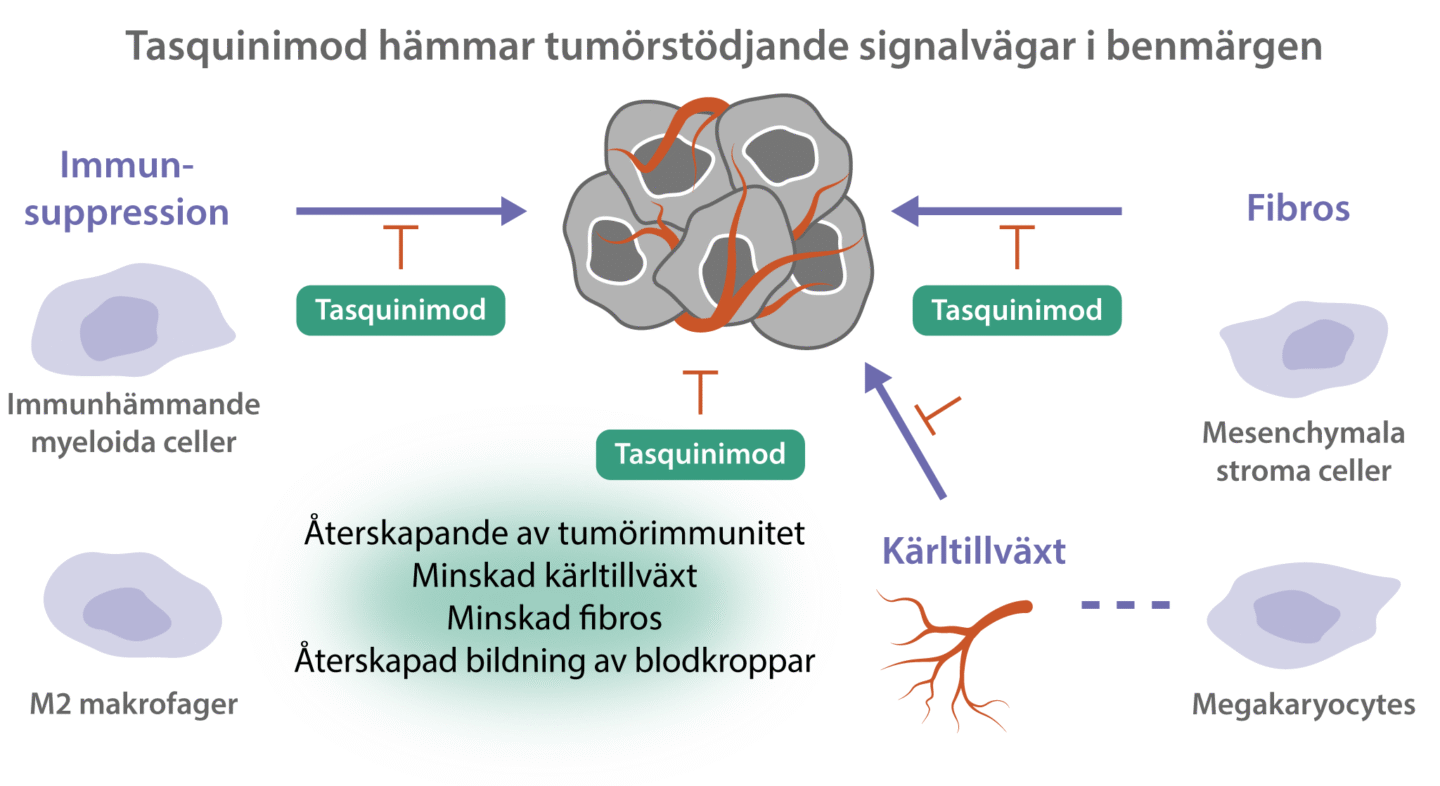
Tumörmikromiljön i benmärgen är avgörande för utvecklingen av hematologiska cancerformer och en nyckelfaktor för återkommande sjukdom samt resistens mot behandling.
Tasquinimod riktar sig mot celler i benmärgens mikromiljö, immunsuppressiva myeloida celler, endotelceller och mesenkymala celler, vilka har en central roll i utvecklingen av hematologiska cancerformer. Tasquinimod påverkar funktionen hos dessa celler vilket leder till minskad tumörtillväxt, minskad fibrosbildning och en återställd blodbildning.
Myelofibros
Myelofibros är en sällsynt form av blodcancer. Den köns- och åldersjusterade incidensen uppskattas till cirka 1,5 fall per 100.000 personer med en prevalens på 12 patienter per 100.000 personer (Slowley et al., 2024). Detta skulle motsvara en prevalens på mer än 100.000 personer med myelofibros i EU, USA, Storbritannien och Japan.
Den bakomliggande orsaken till myelofibros är okänd. Patienter med myelofibros har en onormal produktion av blodbildande celler som leder till att frisk benmärg ersätts med ärrvävnad (fibros).
På grund av bristen på normal produktion av blodkroppar uppvisar patienter vanligtvis avvikelser i laboratorievärden såsom anemi och förändringar i antalet vita blodkroppar och differentiering av blodkroppar. Senare symptom inkluderar förstoring av mjälten, ökad risk för infektioner, nattliga svettningar och feber. Myelofibros är associerat med förkortad överlevnad på grund av bland annat benmärgssvikt och omvandling till akut leukemi.
Aktuella behandlingar och marknad
Myelofibros kan behandlas med benmärgstransplantation för lämpliga individer, erytropoietin för att hantera anemi och JAK2-hämmare för att minska mjältens storlek. Idag är följande läkemedel godkända för dessa patienter som symptomriktad terapi: Hydroxy-urea, ruxolitinib, momelotinib, fedratinib och pacritinib (de fyra sistnämnda är JAK2 hämmare, JAKi). För närvarande finns det inga godkända terapier som skulle upphäva benmärgsfibros vid myelofibros och det finns endast begränsat antal behandlings¬alternativ tillgängliga för patienter vars sjukdom går i progression vid behandling med JAKi eller som inte tolererar JAKi.
Försäljningen av läkemedel för behandling av myelofibros på de 8 stora läkemedelsmarknaderna (USA, 5EU, Japan och Kina) uppgick 2021 till 2,3 miljarder USD och bedöms uppgå till 2,9 miljarder USD år 2031 (Global Data Report March 2023 – Myelofibrosis – Eight Market Drug Forecast and Market Analysis 2021 – 2031)
Myelofibros: Behov av sjukdomsmodifierande behandling

Källa: GlobalData mars 2023. De 8 största marknaderna (USA, EU5, Japan och Kina). Presenterade data baseras på prognos för 2031.
Tasquinimod i myelofibros
Prekliniska studier har visat att tasquinimod minskar myeloproliferation, splenomegali (förstorad mjälte) och fibros i modeller av myelofibros (Leimkühler et al. Cell Stem Cell. 2021, Gleitz et al HemaSphere, 2025). Prekliniska experiment med maligna celler från patienter har vidare visat att tasquinimod fungerar synergistiskt med en JAK- eller BET-hämmare för att minska mjältens storlek och förlänga överlevnaden (Fiskus et al. Blood 2023, Fiskus et al. Blood 2024). Dessa lovande resultat tyder på att tasquinimod skulle kunna vara ett värdefullt tillskott till behandlingsalternativen för patienter med myelofibros.
I samarbete med Erasmus MC, Nederländerna och The University of Texas MD Anderson Cancer Center, USA, kommer Active Biotech utvärdera myelofibros som en ny särläkemedelsindikation med ett potentiellt högt kommersiellt värde för tasquinimod inom hematologiska cancerformer. I februari 2022 tecknades ett globalt patentlicensavtal med Oncode Institute, som agerar på uppdrag av Erasmus MC, för tasquinimod vid myelofibros. Enligt avtalet ger Oncode Institute till Active Biotech en global exklusiv licens för att utveckla och kommersialisera tasquinimod vid myelofibros.
Proof-of-concept-studier med tasquinimod i myelofibros-patienter pågår i Europa och på MD Anderson Cancer Center, Texas, USA.
Studien i Europa genomförs av forskningsnätverket HOVON (Stichting Hemato-Oncologie voor Volwassenen Nederland) med deltagande kliniker i Nederländerna och Tyskland. Studien är i huvudsak finansierad av Oncode Institute. Prekliniska resultat från samarbetet med en forskargrupp vid MD Anderson presenterades i december 2023 vid en muntlig session vid American Society of Hematologys (ASH) årsmöte i San Diego, USA och 2024 som poster vid det årliga mötet för American Society of Hematology (ASH) i San Diego, USA. Resultaten visade tasquinimods effekt som monoterapi och i kombination med godkända och prövningsläkemedel i modeller av avancerad myelofibros.
Dessa positiva resultat motiverar den kliniska studien i patienter med myelofibros vid MD Anderson.
Tasquinimod beviljades särläkemedelsstatus för myelofibros av den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) i maj 2022.
Pågående klinisk utveckling i myelofibros
Två kliniska Proof-of-concept studier med tasquinimod i myelofibros pågår i USA och Europa.
- Studien i USA utförs på MD Anderson Cancer Center
- Studien i Europa genomförs i ett forsknings¬nätverk HOVON (Stichting Hemato-Oncologie voor Volwassenen Nederland) med deltagande kliniker i Nederländerna och Tyskland. Studien är finansierad av Oncode Institute.
FDA har beviljat särläkemedelsstatus för tasquinimod i myelofibros i maj 2022.
Mer information om studierna finns i rutan nedan och på www.clinicaltrials.gov
Multipelt myelom
Multipelt myelom är en obotlig form av blodcancer där onormala plasmaceller i benmärgen växer okontrollerat, medan andra blodbildande celler, som vita och röda blodkroppar och blodplättar, trängs undan. Detta leder till blodbrist, infektioner, nedbrytning av benvävnad och njursvikt.
Trots nya behandlingar, som avsevärt har förbättrat livslängden för patienter med multipelt myelom, är sjukdomens biologiska heterogenitet och uppkomsten av läkemedelsresistens en stor utmaning och det medicinska behovet av innovativa behandlingsmetoder är fortfarande stort.
Marknaden för behandling av multipelt myelom
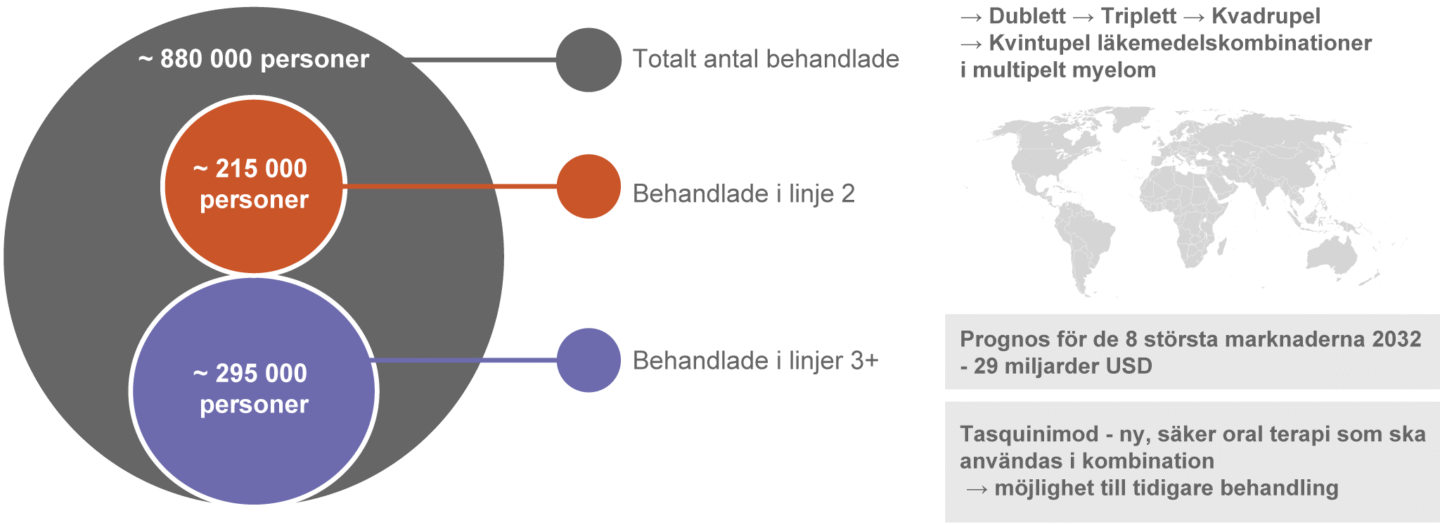
Antalet diagnostiserade fall av multipelt myelom på de åtta största marknaderna (USA, 5 största EU marknaderna, Japan och Kina) uppgick 2022 till cirka 317 000 och förväntas öka till cirka 352 000 år 2032. Under 2022 stod USA för 49 procent av de diagnostiserade fallen, de 5 stora EU-marknaderna för 26 procent och Japan och Kina tillsammans för 25 procent. (Global Data Report July 2024, Multiple Myeloma – Eight Market Drug Forecast 2022 – 2032).
Försäljningen av läkemedel för behandling av multipelt myelom på de åtta största läkemedelsmarknaderna uppgick2022 till 21,2 miljarder USD och bedöms uppgå till 29,3 miljarder USD 2032 (Global Data Report July 2024, Multiple Myeloma – Eight Market Drug Forecast 2022 – 2032).
Marknaden för läkemedel vid behandling av multipelt myelom växer starkt och förväntas visa fortsatt god tillväxt som en följd av ökad incidens på grund av den högre förekomsten av en äldre befolkning, längre progressionsfri och total överlevnad och minskad dödlighet tack vare att nya behandlingar och kombinationsalternativ är tillgängliga. Av den bedömda totalmarknaden 2032 representerar USA cirka 68 procent, de fem största marknaderna inom EU cirka 20 procent samt Japan och Kina cirka 4 respektive 8 procent. (Global Data Report July 2024, Multiple Myeloma – Eight Market Drug Forecast 2022 – 2032).
Multipelt myelom – en viktig marknad som drivs av nya behandlingsalternativ
Källa; Global Data Report July 2024, Multiple Myeloma – Eight Market Drug Forecast 2022-2032.
Befintliga behandlingar
Multipelt myelom-patienter genomgår flera olika behandlingar. I såväl tidiga som sena behandlingar är målet att reducera tumörbörda, lindra symptom och därigenom uppnå en så lång period av effektiv sjukdomskontroll som möjligt. För att stödja djupare och hållbara effekter samt att övervinna behandlingsresistens behandlas patienter standardmässigt med kombinationer av läkemedel från tillgängliga produktklasser. För närvarande domineras marknaden av läkemedel som kan delas in i följande huvudklasser: immunmodulerande imider (ImiDs), proteasomhämmare (PI), monoklonala antikroppar, bispecifika antikroppar, kimeriska antigenreceptor-T celler (CAR-T) samt alkylerande medel.
Sjukdomsförlopp i multipelt myelom

Tasquinimod i multipelt myelom
Tasquinimod kommer att utvecklas som en ny produktklass med en distinkt och ny verkningsmekanism och har därmed möjlighet att övervinna problemet med läkemedelsresistens. Den kliniska säkerhetsprofilen för tasquinimod är välkänd från tidigare kliniska fas I-III-studier. Med tanke på den goda tolerabiliteten och möjligheten att kombinera med tillgängliga produktklasser har tasquinimod potential att över tid expandera från en initial position som 3:e linjens behandling till tidigare behandlingslinjer. Det finns en betydande marknadsmöjlighet för ett nytt läkemedel i en ny produktklass för behandling av multipelt myelom.
Tasquinimod beviljades särläkemedelsstatus för multipelt myelom av den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) år 2017.
Pågående klinisk utveckling
Med prekliniska data och tidigare klinisk erfarenhet av tasquinimod som utgångspunkt påbörjades en klinisk studie och första patienten doserades i augusti 2020. Studien har rekryterat patienter med relapserande eller refraktärt multipelt myelom som genomgått åtminstone en behandling för myelom och genomförs i två steg:
- I första steget (A) utvärderas tasquinimod som en monoterapi
- I andra steget (B) utvärderas kombinationen av tasquinimod och en oral standardbehandling för myelom (IRd; ixazomib, lenalidomid, dexametason)
Rekryteringen är avslutad och data analyseras.
Mer information om studien finns i rutan nedan. och på www.clinicaltrials.gov
Tidigare klinisk erfarenhet av tasquinimod
Tasquinimod har varit under utveckling för behandling av prostatacancer och har genomgått ett kliniskt utvecklingsprogram i fas I-III. Resultaten från fas III-prövningen i prostatacancer visade att tasquinimod förlängde den progressionsfria överlevnaden (progression free survival, PFS) men inte den totala överlevnadstiden (overall survival, OS) jämfört med placebo i denna patientpopulation och utvecklingen för prostatacancer avslutades. Tasquinimod studerades i både friska försökspersoner och cancerpatienter. Kliniska effekter och god säkerhet har visats i fler än 1 500 patienter, vilket motsvarar mer än 650 patientår av exponering för tasquinimod. Omfattande dataset inklusive regulatoriskt paket med preklinisk och klinisk säkerhet och CMC-dokumentation i full kommersiell skala har genererats.
